- Informacje
- Czat SI
Czy ten dokument był pomocny?
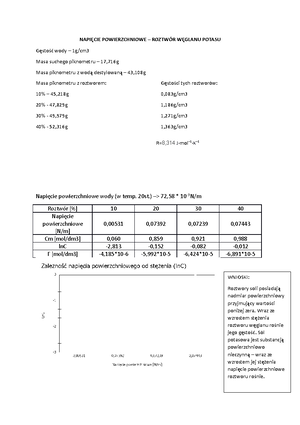
5 Analiza widmowa absorpcyjna
Kurs: Chemia Fizyczna
6 Dokumenty
Studenci udostępnili 6 dokumentów w tym kursie
Uniwersytet: Uniwersytet Przyrodniczy we Wroclawiu
Czy ten dokument był pomocny?

1
V Analiza widmowa absorpcyjna
Cel ćwiczenia:
Wyznaczenie maksimum absorpcji formy zasadowej i kwasowej barwnika
organicznego. Wyznaczenie molowego współczynnika absorpcji dla formy
zasadowej i kwasowej barwnika organicznego.
W dwóch kolbach miarowych o pojemności 50 cm3 student otrzymuje po 1 cm3 roztworu barwnika
o stężeniu 0.1% rozcieńczonego wstępnie niewielką ilością wody.
Masa molowa barwnika wynosi 695.67, gęstość roztworów barwnika przyjąć równą 1 g/cm3.
Wykonanie ćwiczenia:
I. Widmo absorpcyjne formy zasadowej barwnika organicznego
1)
Do otrzymanego roztworu dodać 5 cm3 0.05 M roztworu KOH i dopełnić wodą destylowaną
do kreski. Wymieszać dokładnie.
2)
Jedną kuwetę napełnić przygotowanym roztworem, a drugą wodą destylowaną. Kuwety
umieścić w spektrofotometrze i wykonać pomiary absorbancji roztworu w obszarze
spektralnym od 400 do 700 nm zmieniając długość fali co 20 nm.
Przy pomiarach pamiętać o kompensacji absorpcji rozpuszczalnika, która może być różna dla
różnych długości fali.
3)
Opracowanie wyników
Pomiary przedstawić w Tabeli 1.
Narysować wykres zależności absorbancji od długości fali światła padającego. Wyznaczyć
długość fali odpowiadającą maksimum absorpcji formy zasadowej barwnika (λmax Z).
II. Widmo absorpcyjne formy kwasowej barwnika organicznego
1)
Do otrzymanego roztworu dodać 5 cm3 0.05 M roztworu HCl i dopełnić wodą destylowaną
do kreski. Wymieszać dokładnie.
2)
Jedną kuwetę napełnić przygotowanym roztworem, a drugą wodą destylowaną. Kuwety
umieścić w spektrofotometrze i wykonać pomiary absorbancji roztworu w obszarze
spektralnym od 400 do 700 nm zmieniając długość fali co 20 nm.
Przy pomiarach pamiętać o kompensacji absorpcji rozpuszczalnika, która może być różna dla
różnych długości fali.
3)
Opracowanie wyników
Pomiary przedstawić w Tabeli 2.
Narysować wykres zależności absorbancji od długości fali światła padającego. Wyznaczyć
długość fali odpowiadającą maksimum absorpcji formy zasadowej barwnika (λmax K).